提问者:拾欢
1.化学小题狂做,选择性必修一60页的第五题的b选项,为什么他是分离出氯化钠晶体?而不是氯化钾晶体

编辑解答:
选项中既然写的物质是KNO3和NaCl,就说明溶液中主要的物质就是这两种,原溶液中都没有KCl,所以KCl不可能析出来(可以举特例来理解:比方溶液中含5 mol KNO3,8 mol NaCl,此时你若认为溶液中含KCl,那溶液中肯定还含有NaNO3。所以溶液中不能发生反应的离子,就按题干中给出的物质来考虑)。
2.化学小题狂做,选择性必修一60页的第八题,D选项,他为什么?随着氢氧化钠溶液的加入,离子浓度逐渐增大,HA是酸啊,酸碱中和不是变成水了吗?离子浓度不应该减小吗?
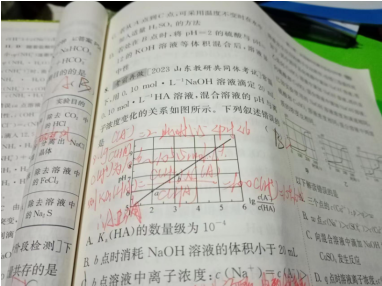
编辑解答:
D选项,HA是弱酸,只能部分电离,随着NaOH的加入,溶液中发生反应HA+NaOH==NaA+H2O,虽然生成了水,该反应相当于将弱电解质HA转化为强电解质NaA,溶液中Na+、A-浓度大大增加,所以溶液中总的离子浓度会增大。
3.化学小题狂做,选择性必修一62页第14题的第四小问,碳酸钠的ph=12不是意味着氢离子浓度是1×10-12次方吗?所以他说电离的氢离子之比不是1:1:1吗?

编辑解答:
碳酸钠的pH=12,显碱性,是由于碳酸根的水解导致的,碳酸根的水解能促进水的电离,所以水电离出的OH-的浓度为10-2 mol·L-1,水电离出的OH-的浓度和水电离出的H+的浓度相等,所以水电离出的H+的浓度也为10-2 mol·L-1。注意区分溶液中的H+的浓度和水电离出的H+的浓度。



发表评论 取消回复