铁、铜及其化合物(典型例题)
一、规律总结在混合溶液中发生化学反应时,通常有明显的先后顺序,凡有后续反应的一定不会首先发生,如本题中有Fe3+存在时,不会发生反应Fe+CuCl2=== FeCl2+Cu,因为存在后续反应2FeCl3+Cu 例1 用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是( )
A. 若无固体剩余,则溶液中一定有Fe3+
B. 若有固体存在,则溶液中一定有Fe2+
C. 若溶液中有Cu2+,则一定没有固体析出
D. 若溶液中有Fe2+,则一定有Cu析出
【答案】B
【解析】用FeCl3溶液腐蚀印刷电路板上铜的反应方程式为2FeCl3+Cu====== 2FeCl2+CuCl2,因此在解答这类试题时,应注意反应的先后顺序,学会有序思维分析,以提高解题的效率与正确率。2FeCl2+CuCl2,所得溶液为FeCl3、FeCl2、CuCl2的混合溶液或FeCl2、CuCl2的混合溶液,向其中加入铁粉,可能发生的反应依次为Fe+2FeCl3===3FeCl2、Fe+CuCl2===FeCl2+Cu。若无固体剩余,说明只发生反应Fe+2FeCl3===3FeCl2,所得溶液可能是FeCl3、FeCl2、CuCl2的混合溶液或FeCl2、CuCl2的混合溶液,溶液中一定含有Fe2+和Cu2+,可能含有Fe3+,A、D错误;若有固体存在,则一定发生反应:Fe+CuCl2===FeCl2+Cu,所得溶液可能是FeCl2溶液或FeCl2、CuCl2的混合溶液,溶液中一定含有Fe2+,可能含有Cu2+,B正确,C错误。
二、易错分析
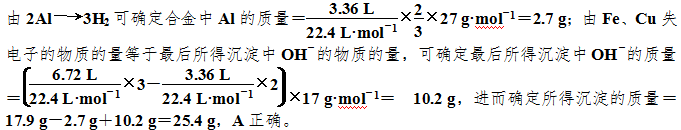
如果不注意Al(OH)3可溶于过量NaOH溶液,则易错选D。如果不能巧用守恒思维,将会使问题变得相当复杂,甚至得不出正确答案,因此凡遇化学计算问题,建议多用守恒思维。例2 将17.9 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体3.36 L(标准状况)。另取等质量的合金溶于过量的稀硝酸中,生成6.72 L NO(标准状况,唯一还原产物),向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为( )
A. 25.4 g B. 19.6 g C. 22.4 g D. 33.2 g
【答案】A
【解析】在Al、Fe、Cu三种金属中,能与NaOH溶液反应产生H2的只有Al,但三种金属都可以溶于过量的稀硝酸,分别转化为Al3+、Fe3+和Cu2+,三种金属离子与过量NaOH溶液反应后又分别转化为AlO2、Fe(OH)3和Cu(OH)2,根据电子得失守恒,



发表评论 取消回复