提问者:照影.
陕西,四月三日, 化学,《高中化学小题狂做》,26页,12题第3问第1空,疑惑是:为什么溶液质量增加63克 溶解锌65克 生成氢气2克

编辑解答:
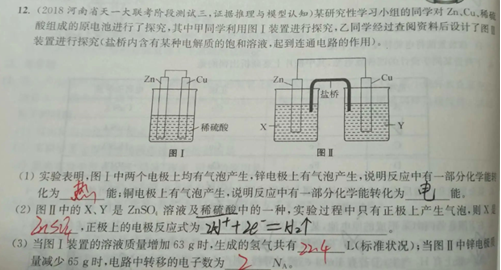
解答此类题目,首先写出正、负极的电极反应式,然后根据转移电子守恒确定正、负极溶液质量的变化。
解析:图Ⅰ装置为原电池,Zn为负极,负极反应式Zn-2e-=Zn2+,负极Zn溶解,溶液质量增加65 g,Cu为正极,正极反应式为2H++2e-=H2,正极生成H2,溶液质量减少2 g,则溶液中转移2mol电子时,溶液总质量增加63 g。
故可得出溶液质量增加63 g, 溶解Zn的质量为 65g、 生成H2 的质量为2 g。

微信小程序
微信扫一扫体验

微信公众账号
微信扫一扫加关注
评论 返回
顶部

发表评论 取消回复